COVID-19: tất cả các loại vắc xin, thuốc uống phòng, điều trị Covid-19 hiện nay
Tên khác: 2019 Novel Coronavirus; 2019-nCoV; Virus corona; Viêm phổi do vi-rút corona mới; Nhiễm SARS-CoV-2
1. COVID-19 là gì; 2. Triệu chứng; 3. Các loại vắc-xin phòng ngừa covid-19; 4. Quá trình lây truyền; 5. Phòng ngừa; 6. Nếu bạn bị bệnh; 7. Các yếu tố rủi ro; 8. Điều trị; 9. Vắc xin điều tra
COVID-19 là gì?
COVID-19 là bệnh do nhiễm vi rút SARS-CoV-2, được xác định lần đầu tiên ở thành phố Vũ Hán, thuộc tỉnh Hồ Bắc của Trung Quốc vào tháng 12 năm 2019. COVID-19 trước đây được gọi là 2019 Novel Coronavirus (2019-nCoV) bệnh đường hô hấp trước khi Tổ chức Y tế Thế giới (WHO) công bố tên chính thức là COVID-19 vào tháng 2 năm 2020.
Vi rút SARS-CoV-2 thuộc họ vi rút được gọi là coronavirus, cũng bao gồm vi rút gây cảm lạnh thông thường và vi rút gây ra các bệnh nhiễm trùng nghiêm trọng hơn như hội chứng hô hấp cấp tính nghiêm trọng (SARS) do SARS gây ra -CoV vào năm 2002, và hội chứng hô hấp Trung Đông (MERS), do MERS-CoV gây ra vào năm 2012. Giống như các coronavirus khác, vi rút SARS-CoV-2 chủ yếu gây nhiễm trùng đường hô hấp và mức độ nghiêm trọng của COVID-19 bệnh có thể từ nhẹ đến tử vong.
Bệnh nghiêm trọng do nhiễm trùng là do khởi phát viêm phổi và hội chứng suy hô hấp cấp tính (ARDS).
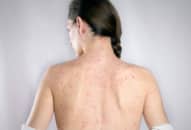
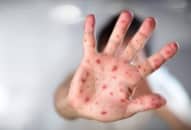
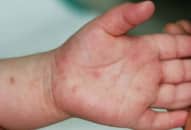
Triệu chứng
Các triệu chứng phổ biến nhất của COVID-19 bao gồm ho khan, sốt, khó thở….. Người ta cho rằng các triệu chứng có thể xuất hiện từ 2-14 ngày sau khi phơi nhiễm mặc dù đã có một số trường hợp cá biệt cho thấy thời gian này có thể lâu hơn. Nếu xuất hiện các triệu chứng, bạn nên nghỉ tại nhà để phòng bệnh lây lan ra cộng đồng. Đeo khẩu trang sẽ giúp ngăn ngừa bệnh lây lan cho người khác.
Theo Trung tâm Kiểm soát và Phòng ngừa Dịch bệnh (CDC), các triệu chứng của COVID-19 bao gồm:
+ Sốt hoặc ớn lạnh
+ Ho
+ Thở gấp hoặc khó thở
+ Mệt mỏi
+ Đau cơ hoặc cơ thể
+ Đau đầu
+ Mất vị giác hoặc mùi mới
+ Viêm họng
+ Nghẹt mũi hoặc chảy nước mũi
+ Buồn nôn hoặc nôn mửa
+ Bệnh tiêu chảy
Quá trình lây truyền
Vi rút SARS-CoV-2 được cho là lây lan từ người sang người qua:
+ Lây truyền qua đường hô hấp các giọt bắn: hắt hơi, ho…
+ Lây truyền qua đường khí dung (khi ai đó ho hoặc hắt hơi trong phòng, các giọt khí dung do nói chuyện và hát)
+ Lây truyền qua tiếp xúc (chạm vào bề mặt bị ô nhiễm sau đó chạm vào miệng, mũi hoặc mắt)
+ Lây truyền trực tiếp (hôn, bắt tay, v.v.)
Cách phòng ngừa bệnh Covid-19
– Cách tốt nhất để ngăn ngừa nhiễm trùng là tránh tiếp xúc với vi rút.
– Cách quan trọng nhất để ngăn ngừa COVID-19 là rửa tay.
– Rửa tay thường xuyên với xà phòng dưới vòi nước trong 20 giây HOẶC sử dụng chất khử trùng tay có cồn (ít nhất 60%).
– Tránh tiếp xúc với những người bị bệnh
– Tránh chạm vào miệng, mũi, mắt hoặc mặt
– Che những cơn ho và hắt hơi (vào khăn giấy hoặc vào khuỷu tay)
– Bề mặt sạch và khử trùng (rượu hoặc thuốc tẩy dựa dung dịch làm sạch hiệu quả nhất đối với các coronavirus)
– Khẩu trang sẽ không bảo vệ bạn khỏi COVID-19 trực tiếp, nhưng có thể giúp giảm nguy cơ tiếp xúc với vi rút, nhắc bạn tránh chạm vào mặt và sẽ giúp ngăn ngừa sự lây lan của bệnh cho người khác
– Hạn chế tiếp xúc xã hội
– Cách ly xã hội
Tăng cường hệ thống miễn dịch của bạn bằng thực phẩm chức năng (vitamin D, vitamin C, vitamin B complex, quercetin, kẽm) có thể giúp ngăn ngừa COVID-19 nghiêm trọng.
Vitamin D: Tốt cho sức khỏe thậm chí có thể giúp cơ thể phòng ngừa COVID-19
Làm gì khi mắc Covid-19
– Ngăn chặn sự lây lan của COVID-19 nếu bạn bị ốm (CDC)
– Khuyến nghị về làm sạch và khử trùng môi trường (CDC)
– Ở nhà. Nếu quý vị đã tiếp xúc với một người nào đó đã có kết quả xét nghiệm dương tính với COVID-19 hoặc một người nào đó đang có các triệu chứng mắc COVID-19, quý vị có thể mất đến hai tuần để các triệu chứng xuất hiện. Để giữ an toàn cho bản thân và những người khác, quý vị nên cách ly bản thân với những người khác trong 14 ngày.
Các yếu tố rủi ro
Các nhà khoa học vẫn đang nghiên cứu các yếu tố nguy cơ đối với COVID-19 nhưng dữ liệu từ CDC Trung Quốc cho thấy người cao tuổi và những người mắc các bệnh từ trước (như bệnh tim, bệnh hô hấp bao gồm hen suyễn và COPD, hoặc tiểu đường) có nguy cơ mắc bệnh nặng hơn. Có nghiên cứu cho rằng những người hút thuốc lá có thể dễ bị nhiễm vi rút SARS-CoV-2 hơn. Cũng có bằng chứng cho thấy những người sử dụng thuốc lá điện tử (vaping) có nguy cơ mắc các bệnh nhiễm trùng đường hô hấp nghiêm trọng cao hơn nhiều.
Ngày 16/3/2020 Một nghiên cứu của Trung Quốc tuyên bố đã phát hiện ra rằng những người có nhóm máu A có thể nhạy cảm hơn với Coronavirus mới (COVID-19).
Ngày 22/3/2020 theo CDC những người từ 65 tuổi trở lên, những người sống trong viện dưỡng lão hoặc cơ sở chăm sóc dài hạn, những người bị suy giảm miễn dịch bao gồm những người đang điều trị ung thư là những người có nguy cơ mắc bệnh nặng cao hơn. Những người nhiễm HIV cũng có thể có nguy cơ mắc bệnh nghiêm trọng cao hơn.
Béo phì là một yếu tố nguy cơ lớn đối với việc mắc COVID-19 nghiêm trọng, nghiên cứu xác nhận vào ngày 8/3/2021
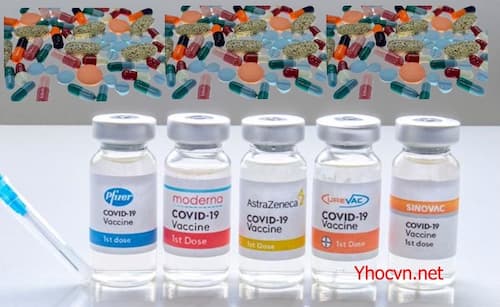
FDA đã phê duyệt Vắc xin COVID-19
– Nền tảng vắc xin Comirnaty (Vắc xin COVID-19, mRNA): vắc xin mRNA
Ngày phê duyệt của FDA: 23/8/2021
Vắc xin Comirnaty được FDA chấp thuận để ngăn ngừa bệnh do coronavirus 2019 (COVID-19) ở bệnh nhân từ 16 tuổi trở lên. Vắc xin Comirnaty là một RNA thông tin được biến đổi nucleoside (modRNA) mã hóa glycoprotein đột biến của virus (S) của SARS-CoV-2
+ Comirnaty chứa vắc xin tương tự như Pfizer-bioNTech COVID-19.
Vắc xin được FDA chấp thuận có tên thương hiệu là Comirnaty và khi được sử dụng theo sự chấp thuận của Cơ quan cho phép sử dụng khẩn cấp (EUA), nó có tên là Pfizer-bioNTech COVID-19.
Công ty: Pfizer Inc. và BioNTech
Vắc xin COVID-19 Có sẵn theo Giấy phép Sử dụng Khẩn cấp của FDA (EUA)
+ Vắc-xin Pfizer-BioNTech COVID-19 (BNT162b2)
Nền tảng vắc-xin: vắc-xin mRNA
BNT162b2 là một RNA thông tin được biến đổi nucleoside (modRNA) mã hóa glycoprotein đột biến của virus (S) của SARS-CoV-2.
Vào ngày 10/5/2021, FDA đã sửa đổi EUA để bao gồm thanh thiếu niên từ 12 đến 15 tuổi. Bệnh nhân từ 16 tuổi trở lên có thể sử dụng vắc xin Comirnaty đã được FDA chấp thuận.
Vào ngày 22/9/2021, EUA đã được sửa đổi để cho phép tiêm một liều tăng cường duy nhất ít nhất 6 tháng sau khi kết thúc đợt chính gồm 2 liều, cho những người từ 65 tuổi trở lên và những người từ 18 đến 64 tuổi. có nguy cơ cao bị COVID-19 nghiêm trọng; và những người từ 18 đến 64 tuổi thường xuyên tiếp xúc với SARS-CoV-2 ở thể chế hoặc nghề nghiệp khiến họ có nguy cơ cao mắc các biến chứng nghiêm trọng của COVID-19 bao gồm COVID-19 nghiêm trọng.
Pfizer-bioNTech COVID-19 chứa cùng loại vắc xin với Comirnaty.
Khi sử dụng vắc-xin theo sự chấp thuận của EUA, vắc-xin có tên Pfizer-bioNTech COVID-19 và khi được sử dụng làm thuốc được FDA chấp thuận, nó có tên thương hiệu là Comirnaty.
– Vắc-xin Moderna COVID-19 (mRNA-1273)
Nền tảng vắc-xin: vắc-xin
mRNA mRNA-1273 là vắc-xin mRNA mã hóa cho dạng ổn định trước khi tiêm chủng của protein Spike (S) của SARS-CoV-2. FDA đã cấp Giấy phép Sử dụng Khẩn cấp (EUA) cho mRNA-1273 vào ngày 18/12/2020 để tiêm chủng chủ động nhằm ngăn ngừa COVID-19 do SARS-CoV-2 gây ra ở những người từ 18 tuổi trở lên.
– Janssen – Johnson & Johnson Vắc xin COVID-19 (Ad26.COV2-S)
Nền tảng vắc xin: Véc tơ siêu vi
Trùng không nhân bản Ad26.COV2-S bao gồm vectơ adenovirus loại 26 tái tổ hợp, nhân bản không có năng lực ở người biểu hiện SARS-CoV- Kháng nguyên 2 tăng đột biến (S) để tạo ra phản ứng miễn dịch và bảo vệ chống lại COVID-19. FDA đã cấp Giấy phép Sử dụng Khẩn cấp (EUA) cho Ad26.COV2-S vào ngày 27/2/2021 để tiêm chủng chủ động nhằm ngăn ngừa COVID-19 do SARS-CoV-2 gây ra ở những người từ 18 tuổi trở lên.
Điều trị Covid-19
Remdesivir (Veklury) là mộtphương pháp điều trị được FDA chấp thuận cho bệnh nhân COVID-19 nhập viện từ 12 tuổi trở lên, những người nặng ít nhất 40 kg.
Remdesivir có Giấy phép Sử dụng Khẩn cấp (ngày sửa đổi 28/8/2020) để điều trị bệnh nhân COVID-19 nhập viện dưới 12 tuổi và nặng ít nhất 3,5 kg. Remdesivir là một loại thuốc kháng vi-rút có hoạt tính kháng vi-rút phổ rộng.
Bamlanivimab (LY-CoV555) là một kháng thể đơn dòng vô hiệu hóa IgG1 của người (mAb) tái tổ hợp hướng vào protein đột biến của SARS-CoV-2. Bamlanivima không còn được phép sử dụng như một liệu pháp đơn trị, để điều trị COVID-19 được chẩn đoán gần đây, sau khi Giấy phép Sử dụng Khẩn cấp của FDA (EUA) bị thu hồi vào ngày 16 tháng 4 năm 2021.
Một liệu pháp kết hợp bao gồm bamlanivimab và etesevimab (xem bên dưới) là Hiện tại có sẵn. Bamlanivimab và etesevimab có hai Giấy phép Sử dụng Khẩn cấp riêng biệt, một cho phép điều trị COVID-19 và một cho phép dự phòng sau phơi nhiễm.
Baricitinib có thể được sử dụng để điều trị COVID-19 theo bản sửa đổi gần đây nhất của Giấy phép Sử dụng Khẩn cấp (EUA) từ FDA vào ngày 28 tháng 7 năm 2021.
Thuốc có thể được sử dụng để điều trị COVID-19 ở người lớn và bệnh nhi nhập viện trong hai năm từ tuổi trở lên cần oxy bổ sung, thở máy không xâm nhập hoặc xâm nhập hoặc oxy qua màng ngoài cơ thể (ECMO). EUA trước đây yêu cầu rằng Baricitinib phải được sử dụng với remdesivir (Veklury) nhưng yêu cầu này đã bị thu hồi và giờ đây nó có thể được sử dụng mà không cần remdesivir.
Baricitinib là chất ức chế Janus kinase (JAK)
Baricitinib được bán trên thị trường dưới tên thương hiệu Olumiant để điều trị bệnh viêm khớp dạng thấp.
Casirivimab và Imdevimab (REGEN-COV) đã được FDA cấp Giấy phép Sử dụng Khẩn cấp vào ngày 21 tháng 11 năm 2020 để điều trị COVID-19 mức độ nhẹ đến trung bình ở bệnh nhân. Họ phải có nguy cơ cao tiến triển thành COVID-19 nặng và phải từ 12 tuổi trở lên và nặng ít nhất 40kg. Các EUA đã được mở rộng để REGEN-COV có thể được sử dụng như dự phòng sau phơi nhiễm ở những bệnh nhân có nguy cơ cao của COVID-19 nặng.
Bamlanivimab và Etesevimab là một liệu pháp kết hợp đã được cho phép theo bản sửa đổi (ban hành ngày 16/9/2021) đối với Giấy phép sử dụng khẩn cấp (EUA) (ban hành ngày 9/2/2021), được sử dụng như một liệu pháp dự phòng sau phơi nhiễm (phòng ngừa) COVID-19 ở người lớn và trẻ em từ 12 tuổi trở lên (trẻ em phải nặng ít nhất 40 kg), những người có nguy cơ cao phát triển COVID-19 nghiêm trọng, kể cả nhập viện hoặc tử vong.
Bamlanivimab và Etesevimab cũng được phép điều trị COVID-19 ở một số bang ở Hoa Kỳ, theo bản sửa đổi đối với EUA do FDA ban hành vào ngày 27/8/2021. Bamlanivimab và Etesevimab có thể được sử dụng để điều trị COVID-19 nhẹ đến trung bình ở người lớn và bệnh nhân từ 12 tuổi trở lên, cân nặng ít nhất 40 kg. Họ phải có kết quả xét nghiệm SARS-CoV-2 dương tính và có nguy cơ cao tiến triển thành COVID-19 nặng, bao gồm cả nhập viện hoặc tử vong. Bamlanivimab và Etesevimab chỉ có thể được sử dụng ở một số tiểu bang, vùng lãnh thổ và khu vực pháp lý của Hoa Kỳ, nơi tần suất kết hợp của các biến thể có khả năng chống lại việc điều trị đa thuốc của bamlanivimab và etesevimab là 5% trở xuống.
Bamlanivimab và Etesevimab là sự kết hợp của hai kháng thể đơn dòng có tác dụng ngăn chặn sự lây nhiễm của virus SARS-CoV-2.
Sotrovimab đã được cấp phép sử dụng khẩn cấp vào ngày 26/5/2021 để điều trị COVID-19 từ nhẹ đến trung bình, ở những bệnh nhân có nguy cơ cao tiến triển thành COVID-19 nặng. Nó KHÔNG được sử dụng cho những bệnh nhân nhập viện do COVID-19 hoặc cần thở oxy.
Đây là một loại kháng thể đơn dòng được thiết kế để ngăn chặn sự xâm nhập của virus SARS-CoV-2 vào các tế bào khỏe mạnh và xóa sạch các tế bào bị nhiễm bệnh.
Tocilizumab (Actemra) đã được cấp phép sử dụng khẩn cấp vào ngày 24 tháng 6 năm 2021 để điều trị COVID-19 ở bệnh nhân nhập viện từ 2 tuổi trở lên. Họ phải theo một chế độ điều trị cụ thể trong bệnh viện. Actemra được FDA chấp thuận để điều trị viêm khớp dạng thấp và các tình trạng viêm nhiễm khác. Actemra là một chất đối kháng thụ thể interleukin-6.
Điều trị
AZD7442: Một tổ hợp kháng thể tác dụng kéo dài (LAAB) được gọi là AZD7442 hiện đang được đánh giá để phòng ngừa và điều trị COVID-19 trong các thử nghiệm giai đoạn cuối với hơn 9.000 người tham gia trên khắp thế giới.
Bemcentinib: Một chất ức chế AXL kinase được gọi là bemcentinib đã được theo dõi nhanh trong một thử nghiệm lâm sàng giai đoạn II ở Vương quốc Anh để nghiên cứu hiệu quả của nó trong điều trị bệnh nhân nhập viện với COVID-19. Bemcentinib trước đây đã được nghiên cứu trên bệnh nhân ung thư và được chứng minh là an toàn và dung nạp tốt. Nó cũng đã được báo cáo cho thấy hoạt động kháng vi-rút mạnh mẽ trong các mô hình tiền lâm sàng chống lại một số loại vi-rút được bao bọc, bao gồm cả vi-rút Ebola và vi-rút Zika, dữ liệu gần đây đã mở rộng điều này bao gồm cả SARS-CoV-2.
Bevacizumab: Một chất ức chế VEGF được gọi là bevacizumab (được bán trên thị trường dưới tên thương hiệu Avastin cho một số loại ung thư) đang được nghiên cứu như một phương pháp điều trị chấn thương phổi cấp tính (ALI) và hội chứng suy hô hấp cấp tính (ARDS) ở những bệnh nhân nặng bị viêm phổi COVID-19 tại Bệnh viện Qilu của Đại học Sơn Đông ở Tế Nam, Trung Quốc.
Chloroquine phosphate: Loại thuốc chống sốt rét cũ chloroquine đã được chứng minh là có nhiều tác dụng kháng virus, bao gồm cả chống coronavirus. Các nghiên cứu ở tỉnh Quảng Đông, Trung Quốc cho thấy rằng chloroquine có thể giúp cải thiện kết quả của bệnh nhân ở những người bị viêm phổi do coronavirus mới.
Colchicine: Một loại thuốc chống viêm cũ được gọi là colchicine đang được nghiên cứu để ngăn ngừa các biến chứng của COVID-19 ở những bệnh nhân có nguy cơ cao. Colchicine từ lâu đã được sử dụng trong điều trị bệnh gút.
Huyết tương dưỡng bệnh: Vào ngày 23/8/2020, FDA đã ban hành giấy phép sử dụng khẩn cấp (EUA) cho huyết tương điều trị dùng trong điều trị COVID-19. FDA đã xác định rằng điều hợp lý để tin rằng huyết tương dưỡng bệnh COVID-19 có thể có hiệu quả trong việc làm giảm mức độ nghiêm trọng hoặc rút ngắn thời gian của bệnh nhân COVID-19 nhập viện với COVID-19.
Dexamethasone: dexamethasone giảm nguy cơ tử vong ở bệnh nặng COVID-19 bệnh nhân lên tới một phần ba, theo các nhà nghiên cứu tại Đại học Oxford ở Anh. Thuốc dường như không giúp bệnh nhân mắc bệnh ít nghiêm trọng hơn.
Favipiravir: Một loại thuốc kháng vi rút có tên favipiravir được báo cáo ngày 17/2/2020 đã nhận được sự chấp thuận tiếp thị ở Trung Quốc để điều trị bệnh cúm, cũng đã được chấp thuận sử dụng trong các thử nghiệm lâm sàng như một phương pháp điều trị viêm phổi do coronavirus mới.
Vào ngày 31/3/2020, Fujifilm thông báo bắt đầu thử nghiệm lâm sàng giai đoạn 3 của Avigan (favipiravir) trên bệnh nhân COVID-19 tại Nhật Bản. Avigan được phép sử dụng ở Nhật Bản như một chất kháng vi-rút trong điều trị cúm. Vào ngày 9/4/2020 Fujifilm thông báo bắt đầu thử nghiệm lâm sàng giai đoạn 2 của favipiravir trên khoảng 50 bệnh nhân COVID-19 ở Hoa Kỳ. Vào ngày 19/6/ 2020, Glenmark Pharmaceuticals Limited đã công bố sự chấp thuận favipiravir (FabiFlu®) để điều trị bệnh nhân COVID-19 mức độ nhẹ đến trung bình ở Ấn Độ.
Fingolimod: Một loại thuốc đã được phê duyệt có tên là fingolimod (được bán trên thị trường với tên thương hiệu Gilenya để điều trị các dạng tái phát của bệnh đa xơ cứng) đang được nghiên cứu như một phương pháp điều trị COVID-19 tại Bệnh viện Liên kết đầu tiên của Đại học Y Phúc Kiến ở Phúc Châu, Trung Quốc.
Fluvoxamine: Chất chống trầm cảm ức chế tái hấp thu serotonin chọn lọc (SSRI) fluvoxamine có thể hoạt động để ngăn ngừa bệnh nghiêm trọng ở những bệnh nhân COVID-19 chưa nhập viện theo một nghiên cứu nhỏ.
Hydroxychloroquine và azithromycin: Trong một nghiên cứu nhỏ do chính phủ Pháp ủy quyền, 20 bệnh nhân mắc COVID-19 đã được điều trị bằng sự kết hợp của thuốc chống sốt rét hydroxychloroquine và thuốc kháng khuẩn macrolide azithromycin (Zithromax). Kết quả cho thấy tất cả các bệnh nhân dùng kết hợp này đều được chữa khỏi về mặt virus học trong vòng 6 ngày điều trị.
Bổ sung kẽm có thể có lợi cho một số người đang được điều trị vì COVID-19 công bố ngày 13/5/2020
NIH bắt đầu thử nghiệm lâm sàng hydroxychloroquine và azithromycin để điều trị COVID-19 (NIH Press Release) ngày 14 tháng 5 năm 2020
Hydroxychloroquine sulfate: Đã được báo cáo trên tạp chí Bệnh Truyền nhiễm Lâm sàng vào ngày 9/3 rằng thuốc sốt rét hydroxychloroquine có hiệu quả trong việc tiêu diệt coronavirus trong các thí nghiệm trong phòng thí nghiệm. Hydroxychloroquine lần đầu tiên được FDA chấp thuận vào năm 1995 dưới tên thương hiệu Plaquenil, và nó cũng được sử dụng trong điều trị bệnh nhân lupus và viêm khớp.
Vào tháng 3/2020, FDA Hoa Kỳ đã ban hành giấy phép sử dụng khẩn cấp (EUA) cho phép sử dụng khẩn cấp hydroxychloroquine sulfate được cung cấp từ Kho dự trữ Quốc gia Chiến lược (SNS) để điều trị COVID-19 ở một số bệnh nhân nhập viện. Vào ngày 15/6/2020, FDA đã thu hồi EUA.
Ivermectin: Một loại thuốc chống ký sinh trùng gọi là ivermectin hiện đang được nghiên cứu để điều trị coronavirus SARS-CoV-2, là loại virus gây ra COVID-19. FDA đã không phê duyệt ivermectin để sử dụng trong điều trị hoặc ngăn ngừa COVID-19 ở người. Tổ chức Y tế Thế giới (WHO) khuyến cáo không sử dụng ivermectin ở bệnh nhân COVID-19, ngoại trừ các thử nghiệm lâm sàng.
Leronlimab: Một chất đối kháng CCR5 được gọi là leronlimab đã cho thấy hứa hẹn trong việc làm dịu ‘cơn bão cytokine’ ở một số ít bệnh nhân COVID-19 bị bệnh nặng nhập viện ở khu vực New York.
Lopinavir và ritonavir: Một sự kết hợp thuốc có tên là lopinavir / ritonavir đã được phê duyệt để điều trị HIV dưới tên thương hiệu Kaletra đang được nghiên cứu kết hợp với thuốc cảm cúm oseltamivir (Tamiflu) ở Thái Lan. Được biết vào ngày 18 tháng 2 năm 2020, một phụ nữ lớn tuổi người Trung Quốc, bệnh nhân đầu tiên nhận được loại “cocktail Thái Lan” tại Bệnh viện Rajvithi ở Bangkok, đã hồi phục hoàn toàn sau khi bị viêm phổi nặng liên quan đến COVID-19. Vào ngày 18 tháng 3 năm 2020, một nghiên cứu trên Tạp chí Y học New England đã báo cáo sự kết hợp lopinavir/ritonavir cho thấy không có lợi ích so với chăm sóc tiêu chuẩn ở bệnh nhân người lớn nhập viện với COVID-19 nặng.
Methylprednisolone: Một glucocorticoid được sử dụng rộng rãi gọi là methylprednisolone đang được nghiên cứu về tính an toàn và hiệu quả trong điều trị viêm phổi do coronavirus mới tại một số bệnh viện ở tỉnh Hồ Bắc, Trung Quốc.
MK-7110 (trước đây là CD24Fc): là một protein phản ứng tổng hợp tái tổ hợp điều tra tiềm năng bậc nhất. Nó hoạt động bằng cách điều chỉnh phản ứng viêm đối với SARS-CoV-2, chủ yếu bằng cách nhắm mục tiêu vào một điểm kiểm tra của con đường miễn dịch mới. Kết quả tạm thời từ một nghiên cứu Giai đoạn 3 cho thấy giảm hơn 50% nguy cơ tử vong hoặc suy hô hấp ở những bệnh nhân nhập viện với COVID-19 mức độ trung bình đến nặng. Vào tháng 4 năm 2021, Merck thông báo ngừng phát triển MK-7110
Molnupiravir (MK-4482): là một tác nhân chống vi rút điều tra mới bằng miệng được phát triển bởi Merck phối hợp với Ridgeback Bio. Molnupiravir hiện đang được đánh giá trong các thử nghiệm lâm sàng Giai đoạn 2/3 ở cả bệnh viện và cơ sở ngoại trú. Ngày hoàn thành chính cho các nghiên cứu Giai đoạn 2/3 là tháng 5 năm 2021.
Peginterferon Lambda: Một liều duy nhất của thuốc kháng vi-rút peginterferon Lambda thử nghiệm đã tăng tốc độ thanh thải SARS-CoV2 ở những bệnh nhân mới được chẩn đoán, không nằm viện theo kết quả của một nghiên cứu giai đoạn 2 được công bố trên Lancet Respiratory Medicine.
PF-07321332: Pfizer đã thông báo bắt đầu nghiên cứu Giai đoạn 1 về PF-07321332, một chất ức chế protease SARS-CoV2-3CL đường uống đã chứng minh hoạt tính chống vi rút in vitro mạnh mẽ chống lại SARS-CoV-2, cũng như hoạt động chống lại các vi-rút corona.
RLF-100: (aviptadil) là một công thức của polypeptide hoạt tính đường ruột (VIP) liên kết với các tế bào phế nang loại 2 trong phổi ức chế các cytokine gây viêm. Vào ngày 6 tháng 8 năm 2020, Relief Therapeutics thông báo rằng họ đã được cấp phép Điều tra Thuốc mới (IND) để thử nghiệm RLF-100 để sử dụng qua đường hít ở những bệnh nhân mắc COVID-19 vừa và nặng nhằm ngăn ngừa sự tiến triển thành suy hô hấp.
Sarilumab: Một chất đối kháng thụ thể interleukin-6 (IL-6) được gọi là sarilumab (được bán trên thị trường dưới tên thương hiệu Kevzara để điều trị viêm khớp dạng thấp) đang được nghiên cứu như một phương pháp điều trị tiềm năng cho hội chứng suy hô hấp cấp tính (ARDS) ở những bệnh nhân bị bệnh nặng do COVID -19.
Statin: Statin (chất ức chế HMG CoA reductase): Họ thuốc giảm cholesterol được nghiên cứu để xác định xem chúng có thể làm giảm mức độ nghiêm trọng của COVID-19 hay không. Statin được cho là có tác dụng chống viêm và điều hòa miễn dịch.
STC3141: Một loại thuốc điều tra được gọi là STC3141 đã được phê duyệt để bắt đầu nghiên cứu lâm sàng giai đoạn II ở Úc để điều trị hội chứng suy hô hấp cấp tính (ARDS) do bệnh nhân COVID-19 mắc phải.
Umifenovir: Một loại thuốc kháng vi-rút có tên là umifenovir (được bán trên thị trường ở Nga dưới tên thương hiệu Arbidol, và cũng có sẵn ở Trung Quốc để điều trị bệnh cúm) đang được nghiên cứu ở Trung Quốc và các quốc gia khác như một phương pháp điều trị COVID-19.
Vắc xin nghiên cứu
Một số công ty dược phẩm và các tổ chức nghiên cứu trên toàn thế giới đang tham gia vào việc phát triển các loại vắc xin tiềm năng.
AZD1222 (trước đây là ChAdOx1 nCoV-19) Nền tảng vắc-xin: Vectơ vi-rút không nhân bản
AZD1222 được phát triển bởi Viện Jenner của Đại học Oxford, với AstraZeneca chịu trách nhiệm phát triển và sản xuất và phân phối trên toàn thế giới. Một thử nghiệm lâm sàng giai đoạn I / II của AZD1222 đã bắt đầu vào tháng 4/2020 để đánh giá tính an toàn, khả năng sinh miễn dịch và hiệu quả của vắc xin trên hơn 1000 tình nguyện viên khỏe mạnh tại một số trung tâm thử nghiệm ở miền nam nước Anh. Kết quả tạm thời được công bố trên The Lancet vào ngày 20/7/2020.
Nền tảng vắc-xin INO-4800: vắc-xin DNA
Inovio Pharmaceuticals, Inc. đã công bố vào ngày 6/4/2020 FDA chấp nhận đơn đăng ký Thuốc mới (IND) cho nghiên cứu mới cho ứng cử viên vắc-xin DNA INO-4800, mở đường cho thử nghiệm lâm sàng Giai đoạn 1. Vào ngày 30/6/2020, công ty đã công bố dữ liệu lâm sàng tích cực tạm thời từ thử nghiệm Giai đoạn 1, với kế hoạch bắt đầu thử nghiệm hiệu quả Giai đoạn 2/3 theo sự đồng tình của các cơ quan quản lý. Vào ngày 28/9/2020, Inovio thông báo rằng giai đoạn 2/3 dự kiến thử nghiệm của INO-4800 đã được tạm dừng lâm sàng một phần theo yêu cầu của FDA.
Nền tảng vắc xin Ad5-nCoV: Adenovirus loại 5 Vector
CanSino Biologics Inc. đã thông báo rằng ứng cử viên vắc xin coronavirus mới tái tổ hợp (Adenovirus loại 5 Vector) (Ad5-nCoV), được đồng phát triển với Viện Công nghệ sinh học Bắc Kinh (BIB), đã được phê duyệt tham gia thử nghiệm lâm sàng giai đoạn 1 tại Trung Quốc. Vào ngày 29/6/2020, công ty thông báo vắc-xin đã nhận được Phê duyệt Thuốc Đặc biệt Cần thiết cho Quân đội ở Trung Quốc.
Nền tảng vắc-xin NVX-CoV2373: Tiểu đơn vị protein
Vào ngày 25/ 5/ 2020, Novavax, Inc. đã công bố bắt đầu thử nghiệm lâm sàng Giai đoạn 1/2 đối với ứng cử viên vắc-xin coronavirus, NVX-CoV2373, một loại protein ổn định, được tạo trước bằng công nghệ hạt nano độc quyền của hãng tá dược (Matrix-M ™) để tăng cường phản ứng miễn dịch và kích thích lượng kháng thể trung hòa cao, trên hai địa điểm ở Úc.
Vào ngày 7/7/2020, công ty đã công bốrằng nó đã được chọn để tham gia Chiến dịch Warp Speed, với sự tài trợ của chính phủ liên bang để hoàn thành quá trình phát triển lâm sàng giai đoạn cuối, bao gồm thử nghiệm lâm sàng giai đoạn 3 quan trọng và phân phối 100 triệu liều NVX-CoV2373 sớm nhất vào cuối năm 2020. Vào ngày 4/8/2020, Novavax đã báo cáo dữ liệu Giai đoạn 1 từ thử nghiệm ngẫu nhiên, mù người quan sát, đối chứng với giả dược Giai đoạn 1/2 của NVX-CoV2373 có và không có chất bổ trợ Matrix-M ™. Vào ngày 24 tháng 8 năm 2020, có thông báo rằng các thử nghiệm Giai đoạn 2 đã bắt đầu, với khoảng 50 phần trăm người tham gia ≥60 tuổi, tại 40 địa điểm trên khắp Hoa Kỳ và Úc.
Nền tảng vắc xin CoronaVac: Công ty TNHH Công nghệ sinh học Sinovac đã ngừng hoạt động đã thông báo về việc bắt đầu thử nghiệm lâm sàng giai đoạn I cho ứng cử viên vắc xin COVID-19 của họ sẽ được tiến hành tại tỉnh Giang Tô, Trung Quốc. Vào ngày 13 tháng 6 năm 2020, Sinovac đã báo cáo kết quả sơ bộ khả quan của giai đoạn I / II thử nghiệm lâm sàng. Vào ngày 6 tháng 7 năm 2020, công ty thông báo rằng Cơ quan quản lý quốc gia Brazil, Anvisa, đã chấp thuận để tiến hành thử nghiệm lâm sàng giai đoạn III của CoronaVac tại Brazil.
V590 và V591 Merck đã công bố hợp tác với IAVI (Sáng kiến vắc xin phòng chống AIDS quốc tế) để phát triển vắc xin điều tra chống lại SARS-CoV-2, sử dụng công nghệ vi rút viêm miệng dạng mụn nước tái tổ hợp (rVSV) làm cơ sở cho vắc xin vi rút Ebola Zaire (Ervebo) . Vào ngày 25 tháng 1 năm 2021, công ty thông báo rằng họ ngừng phát triển các ứng cử viên vắc xin SARS-CoV-2 / COVID-19 (V590 và V591) và xác nhận kế hoạch chuyển đổi trọng tâm thay vì thúc đẩy các ứng cử viên điều trị của mình.
Nền tảng vắc xin SCB-2019: Công ty Dược phẩm Clover Protein đã thông báo rằng những người tham gia đầu tiên đã được sử dụng trong nghiên cứu đầu tiên trên người Giai đoạn 1 đánh giá ứng cử viên vắc xin tiểu đơn vị COVID-19 S-Trimer của công ty (SCB-2019) dựa trên nền tảng công nghệ vắc xin Trimer-Tag © độc quyền. Nghiên cứu Giai đoạn I sẽ đánh giá hai hệ thống bổ trợ – hệ thống bổ trợ đại dịch của GSK, và tá dược CpG 1018 của Dynavax kết hợp với phèn.
COVAC1 Imperial College London thông báo rằng họ đã tiêm chủng cho người tình nguyện khỏe mạnh đầu tiên với ứng cử viên vắc-xin coronavirus COVAC1, được phát triển bằng công nghệ RNA tự khuếch đại (saRNA) mới.
Nền tảng vắc xin GX-19: Vắc xin DNA
Genexine đã công bố phê duyệt thử nghiệm lâm sàng giai đoạn 1 / 2a đối với vắc xin DNA GX-19 tại Hàn Quốc.
CVnCoV Vaccine nền tảng: mRNA vaccine
CureVac AG công bố sự chấp thuận của một giai đoạn 1 thử nghiệm lâm sàng đối với vắcxin mRNA CVnCoV vọng tiếp tục được tiến hành ở Đức và Bỉ vào ngày 17/ 6/2020, và ra mắt của phiên tòa 2a giai đoạn được tiến hành Peru và Panama trên Ngày 29 tháng 9 năm 2020.
Nền tảng Vắc xin Sputnik V: Vectơ Vi rút Không Nhân bản
Vào ngày 4/9/2020, đã có thông báo rằng kết quả của các thử nghiệm lâm sàng giai đoạn I-II đối với vắc xin Nga Sputnik V đã được công bố trên tạp chí The Lancet. Kết quả cho thấy Sputnik V đã tạo ra phản ứng miễn dịch tế bào và dịch thể ổn định ở 100% người tham gia thử nghiệm và không có tác dụng phụ nghiêm trọng nào. Sputnik V sử dụng hai vectơ khác nhau (dựa trên các kiểu huyết thanh adenovirus ở người là Ad5 và Ad26) trong hai mũi tiêm riêng biệt để đạt được phản ứng miễn dịch hiệu quả hơn.
VXA-CoV2-1 Một ứng cử viên vắc-xin COVID-19 dạng uống từ Vaxart, Inc. đã được chọn để tham gia vào nghiên cứu thử thách động vật linh trưởng không phải người (NHP), được tổ chức và tài trợ bởi Operation Warp Speed. Thử nghiệm giai đoạn 1 trên người bắt đầu vào tháng 10/2020.
Cho đến nay, một loại vắc-xin COVID-19 bất hoạt có hiệu quả chống lại tất cả các chủng vi-rút đang được phát triển bởi Viện Sản phẩm Sinh học Vũ Hán thuộc Tập đoàn Dược phẩm Quốc gia Trung Quốc (Sinopharm) và Viện Vi-rút Vũ Hán thuộc Học viện Khoa học Trung Quốc. Kết quả khả quan từ các nghiên cứu lâm sàng Giai đoạn 1 và Giai đoạn 2 đã được báo cáo vào tháng 6/2020, và việc bắt đầu thử nghiệm Giai đoạn 3 sẽ được tiến hành tại Abu Dhabi, UAE đã được công bố vào tháng 7/2020.
BBIBP-CorV Viện Sản phẩm Sinh học Bắc Kinh / Sinopharm đã công bố kết quả đầy hứa hẹn của một thử nghiệm nhỏ đối với ứng cử viên vắc xin bất hoạt BBIBP-CorV của họ ở những người tình nguyện từ 18 đến 80 tuổi vào tháng 10/2020.
Nền tảng vắc xin MRT5500: vắc xin mRNA
Vào ngày 15/10/2020, Sanofi Pasteur và Translate Bio đã công bố kết quả tiền lâm sàng cho ứng cử viên vắc xin dựa trên mRNA MRT5500.
Vào tháng 5 năm 2020, Chính quyền Trump đã công bố Chiến dịch Warp Speed, một mối quan hệ đối tác công tư nhằm tạo điều kiện thuận lợi cho việc phát triển, sản xuất và phân phối các biện pháp đối phó COVID-19 giữa các bộ phận của Bộ Y tế với tốc độ chưa từng có và Dịch vụ Nhân sinh (HHS), bao gồm CDC, FDA, NIH và BARDA.
Theo một bài báo trên The New York Times vào ngày 3/6/2020, Chính quyền Trump đã chọn năm công ty (Moderna Inc, AstraZeneca Plc, Pfizer Inc., Johnson & Johnson, và Merck & Co Inc.) là những ứng cử viên có khả năng sản xuất một loại vắc-xin cho loại coronavirus mới. HHS đã không xác nhận hoặc phủ nhận báo cáo.
Yhocvn.net (Theo drugs.com)
BÀI CÙNG CHỦ ĐỀ:
+ Giảm oxy máu SpO2 ở bệnh nhân Covid-19 nguy hiểm như thế nào, ECMO là gì
+ Năm loại máy, loại thuốc bệnh nhân Covid-19 nên có tại nhà
+ Liệu pháp oxy, thở oxy: tất cả những lưu ý cần biết
+ Sự an toàn, hiểu quả của vắc xin liệu có được đảm bảo, mRNA có ảnh hưởng đến DNA của người?
+ Cấp phép khẩn cấp cho vaccine Covid-19 là quyền của mỗi quốc gia hay phải chờ WHO chấp thuận?
Chưa có bình luận.