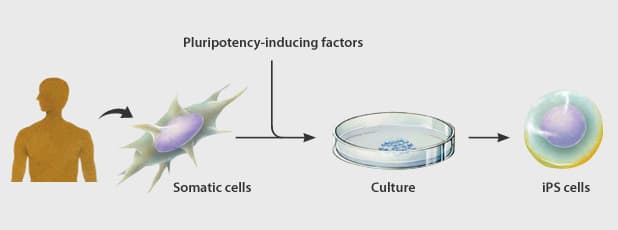
Tế bào gốc đa năng cảm ứng hoặc tế bào iPS được thiết lập bằng cách đưa một số lượng nhỏ gen vào các tế bào soma (biệt hóa) bình thường của con người. Những tế bào vạn năng này có thể biệt hóa thành bất kỳ loại tế bào nào trong cơ thể và sinh sôi nảy nở vô tận trong môi trường nuôi cấy. Các tế bào iPS lần đầu tiên được tạo ra bởi nhóm của Giáo sư Shinya Yamanaka tại Đại học Kyoto.
Tế bào iPS hay iPSC là loại tế bào gốc đa tiềm năng được tạo ra từ các tế bào trưởng thành. Đi tiên phong cho công nghệ tế bào iPS này là phòng thí nghiệm của Shinya Yamanaka tại Kyoto, Nhật Bản. Vào năm 2006, ông đã công bố bốn gen đặc biệt mã hóa cho các yếu tố phiên mã có thể biến đổi từ tế bào trưởng thành trở thành các tế bào gốc đa tiềm năng. Ông được trao giải Nobel 2012 cùng với John Gurdon cho “phát hiện về các tế bào trưởng thành có thể được tái lập trình để trở thành đa tiềm năng”.
Quá trình thay đổi một tế bào từ trạng thái biệt hóa sang trạng thái đa năng được gọi là tái lập trình. Phương pháp do nhóm Yamanaka phát triển đã được chứng minh là có khả năng lặp lại cao, tương đối đơn giản và được coi là một bước đột phá khoa học lớn.
Các tế bào iPS có khả năng được sử dụng như thế nào?
Người ta cho rằng các tế bào iPS sẽ hữu ích trong việc làm sáng tỏ nguyên nhân gây bệnh, phát triển các loại thuốc mới và trong liệu pháp cấy ghép tế bào cũng như các dạng y học tái tạo khác. Y học tái tạo là một liệu pháp nhằm phục hồi các chức năng bị mất do bệnh tật hoặc chấn thương. Ví dụ, y học tái tạo trong trường hợp bệnh đái tháo đường liên quan đến việc cấy ghép các tế bào có khả năng điều chỉnh lượng đường trong máu hoặc trong trường hợp chấn thương khiến các dây thần kinh bị cắt đứt, thì cấy ghép các tế bào thần kinh có thể giúp khôi phục kết nối bị gián đoạn. Các tế bào iPS có thể được sử dụng để tạo ra các tế bào được cấy ghép này.
Trong khi đó, bằng cách tạo ra các tế bào iPS từ các tế bào soma của bệnh nhân mắc các bệnh nan y và khiến chúng biệt hóa thành các tế bào của mô bệnh, các nhà nghiên cứu hy vọng có thể cho phép nghiên cứu làm sáng tỏ nguyên nhân của căn bệnh tương ứng. Một ví dụ là các bệnh phát sinh do những thay đổi trong não, vì các tế bào não cực kỳ khó thu thập và nghiên cứu từ các bệnh nhân sống. Sử dụng các tế bào iPS, các nhà nghiên cứu hy vọng có thể so sánh các tế bào khỏe mạnh và bị bệnh.
Các tế bào iPS cũng sẽ cho phép đánh giá và thử nghiệm hiệu quả, tác dụng phụ và độc tính của dược phẩm theo cách mà cơ thể người không thể thực hiện được, điều này sẽ tạo động lực lớn cho sự phát triển thuốc mới. Sau khi đảm bảo an toàn, chúng ta có thể mong đợi thêm các ứng dụng trong y học tái tạo, bao gồm liệu pháp cấy ghép tế bào liên quan đến cấy ghép tế bào mô và cơ quan được tạo ra bằng cách biệt hóa từ các tế bào iPS có nguồn gốc từ bệnh nhân.
Nghiên cứu nào đã dẫn đến việc tạo ra các tế bào iPS?
Các nhà khoa học đã nghiên cứu khả năng của các phương pháp tái tạo để điều trị các tình trạng y tế của con người trong nhiều thập kỷ. Năm 1981, Giáo sư Martin Evans và cộng sự tại Đại học Cambridge (Anh) đã thành lập dòng tế bào gốc phôi chuột (ES) đầu tiên. Tế bào ES là một loại tế bào đa năng nổi tiếng, có thể tạo ra bất kỳ loại tế bào nào trong cơ thể.
Mười bảy năm sau, Giáo sư James Thomson đã thành lập dòng tế bào ES đầu tiên của con người, với tư cách là nguồn sinh lý đầu tiên của các tế bào con người đa năng đã làm tăng sự quan tâm đến tiềm năng của các ứng dụng y học tái tạo. Tuy nhiên, các tế bào ES của con người là một vấn đề, bởi vì nguồn gốc của chúng liên quan đến việc phá hủy phôi người ở giai đoạn đầu còn sót lại từ các quy trình thụ tinh trong ống nghiệm, điều này đã dẫn đến nhiều cuộc tranh luận về đạo đức và tôn giáo, đồng thời khiến chính phủ ở nhiều quốc gia đặt ra các hạn chế đối với việc tạo ra chúng. dụng, làm cho chúng trong một số trường hợp khó sử dụng ngay cả cho các mục đích nghiên cứu hợp pháp. Ngoài ra, do khó khăn trong việc lấy tế bào ES từ từng bệnh nhân.
Nhiều phòng thí nghiệm trên khắp thế giới đang nghiên cứu các nguồn tế bào đa năng thay thế như một cách để tránh những vấn đề này khi nhóm của Giáo sư Shinya Yamanaka lần đầu tiên báo cáo về tế bào iPS của chuột vào năm 2006, ngay sau đó là tế bào iPS của người vào năm 2007.
Tế bào iPS khác với tế bào gốc phôi người như thế nào?
Các tế bào gốc phôi người (ES) được thiết lập bằng cách loại bỏ các tế bào từ phôi 6-7 ngày tuổi và nuôi cấy chúng trong môi trường nuôi cấy. Ngược lại, các tế bào gốc đa năng cảm ứng có thể được tạo ra bằng cách sử dụng các tế bào từ cơ thể trưởng thành, chẳng hạn như da, rất nhiều và vô hại để loại bỏ. Vì điều này không yêu cầu phá hủy phôi thai nên nó tránh được nhiều vấn đề đạo đức xung quanh các tế bào ES của con người. Hơn nữa, không giống như các tế bào ES của con người, có thể lấy được các tế bào iPS dành riêng cho bệnh nhân và biến chúng thành các loại tế bào biệt hóa khác nhau, sau đó có thể cấy ghép trở lại bệnh nhân mà không có nguy cơ bị đào thải miễn dịch.
Nhóm của Giáo sư Shinya Yamanaka lần đầu tiên tạo ra các tế bào iPS như thế nào?
Giáo sư Shinya Yamanaka đang nghiên cứu các gen biểu hiện trong tế bào gốc phôi (ES) và vào năm 2000 bắt đầu tìm kiếm một nguồn tế bào gốc đa năng thay thế. Nhóm của ông đã phát hiện ra rằng bằng cách đưa một vài trong số các gen này – Oct3/4, Sox2, KLf4 và c-Myc – vào tế bào soma của chuột (nguyên bào sợi) bằng vec tơ retrovirus và nuôi cấy tế bào trong vài tuần, các tế bào này có thể được lập trình lại đến trạng thái đa năng giống như trạng thái của các tế bào ES, có thể biệt hóa thành các loại tế bào khác nhau trong cơ thể. Nhóm của ông lần đầu tiên báo cáo thành công với tế bào iPS của chuột vào năm 2006 và tế bào iPS của người vào tháng 11 năm 2007.
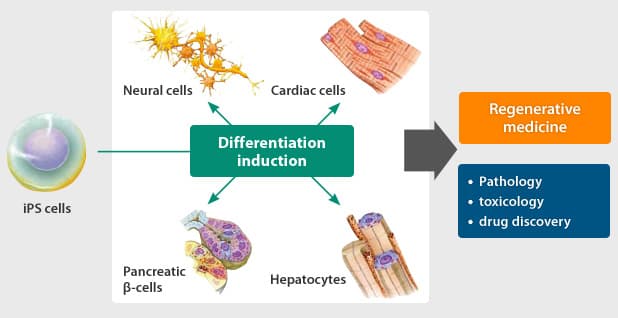
Có phương pháp nào khác để tạo tế bào iPS không?
Các phòng thí nghiệm trên khắp thế giới đang nghiên cứu các phương pháp mới để tạo ra tính đa năng của tế bào. Ví dụ, đồng thời với báo cáo về các tế bào iPS của con người bởi nhóm Shinya Yamanaka, nhóm của Giáo sư James Thomson ở Hoa Kỳ đã báo cáo một kỹ thuật để tạo ra các tế bào iPS của con người bằng cách sử dụng một tổ hợp gen hơi khác – Oct3/4, Sox2, Nanog và Lin28 .
Một số nhóm khác đã sử dụng các vectơ virus khác nhau, chẳng hạn như lentivirus và adenovirus, thay thế gen bằng hóa chất và sử dụng protein tái tổ hợp.
Sau bước đột phá đầu tiên, CiRA đã nghiên cứu các phương pháp tạo khác nhau và đã thành công trong việc thiết lập một phương pháp tạo với mức độ an toàn cao hơn. Ví dụ, điều này đã đạt được bằng cách sử dụng gen L-Myc để thay thế gen c-Myc, được cho là làm tăng nguy cơ sinh ung thư và bằng cách sử dụng các plasmid episomal để tạo thành công tế bào iPS của người mà không cần sử dụng vec tơ virut, được cho là gây ung thư bằng cách làm hỏng bộ gen ban đầu.
Tế bào iPS có thể được tạo ra từ những người ở mọi lứa tuổi không?
Có, ở Nhật Bản, iPSC được lấy từ những người trẻ từ 6 tuổi đến 81 tuổi. Không có sự khác biệt đáng kể nào về tính đa năng được thể hiện bởi các tế bào này.
Khi nào thì có thể sử dụng các tế bào iPS trong phát triển thuốc mới (khám phá thuốc) và y học tái tạo?
So với năm 2006, khi thế hệ tế bào iPS lần đầu tiên được công bố, nghiên cứu về tế bào iPS đã có những bước tiến vượt bậc. Một trong những thành tựu của nó là thúc đẩy nghiên cứu thiết lập các tiêu chuẩn cho các tế bào iPS, thiết lập các phương pháp tạo ra các tế bào iPS an toàn và xác nhận hiệu quả điều trị và sự an toàn khi sử dụng động vật thí nghiệm. Vào năm 2014, một nghiên cứu lâm sàng đã bắt đầu cấy ghép các tế bào võng mạc có nguồn gốc từ tế bào iPS được tạo ra từ các tế bào soma của bệnh nhân vào những bệnh nhân bị thoái hóa điểm vàng do tuổi tác. Vào năm 2018, một thử nghiệm lâm sàng đã bắt đầu cấy ghép các tế bào thần kinh sản xuất dopamine được tạo ra từ nguồn tế bào iPS để phục vụ cho y học tái tạo vào bệnh nhân mắc bệnh Parkinson. Nghiên cứu cũng đang được tiến hành để khám phá các loại thuốc điều trị các bệnh nan y bằng cách sử dụng các tế bào có nguồn gốc từ tế bào iPS được tạo ra từ các tế bào của bệnh nhân: vào năm 2017, một thử nghiệm lâm sàng đã bắt đầu cho một loại thuốc ứng cử viên cho FOP (loạn sản xơ hóa xương tiến triển), vào năm 2019, cho bệnh xơ cứng teo cơ một bên (ALS) ) bệnh nhân và vào năm 2020, một bệnh nhân mắc bệnh Alzheimer có tính chất gia đình. Các nhà nghiên cứu ở Nhật Bản và nước ngoài đang tiếp tục nghiên cứu để đưa các phương pháp điều trị y tế mới sử dụng tế bào iPS đến với càng nhiều bệnh nhân càng sớm càng tốt.
Những mô và cơ quan nào có thể có tế bào được tạo ra từ tế bào iPS?
Theo kết quả nghiên cứu hiện tại được báo cáo từ Nhật Bản và nước ngoài, các tế bào iPS có khả năng biệt hóa thành các tế bào cấu thành của nhiều loại mô và cơ quan, bao gồm dây thần kinh, cơ tim và máu. Tuy nhiên, các cơ quan phức tạp hơn vì cấu trúc ba chiều (3D) của chúng. Gan nhỏ (Nature. 2013 ngày 25 tháng 7; 499: 481-484) và việc tạo ra các cơ quan đa tạng nhỏ (gan, ống mật, tuyến tụy) (Nature 2019 ngày 25 tháng 9; 574: 112-116) đã được báo cáo, nhưng vẫn chưa có không có báo cáo về 3D lớn, các cơ quan chức năng có kích thước của con người. Đây là lĩnh vực đòi hỏi sự kết hợp giữa công nghệ tế bào iPS với máy in 3D, vật liệu sinh học và các công nghệ khác.
Khi công nghệ tế bào iPS được thiết lập và các ứng dụng y tế đã trở nên khả thi, liệu có thể điều trị tất cả các bệnh và chấn thương không?
Về lý thuyết, các tế bào iPS có thể biệt hóa thành bất kỳ loại tế bào nào tạo nên cơ thể, nhưng điều đó không nhất thiết có nghĩa là chúng sẽ được áp dụng cho bất kỳ mục đích nào. Một ví dụ liên quan có thể là các trường hợp chấn thương não nơi lưu trữ ký ức, vì sự hình thành ký ức và các câu hỏi liên quan vẫn là một bí ẩn lớn trong lĩnh vực khoa học thần kinh. Cũng có thể có những tình huống thay vì sử dụng tế bào, tốt hơn là nên chờ đợi sự ra đời của các loại thuốc và thiết bị điều trị mới. Bằng cách hợp tác phát triển song song với các lĩnh vực nghiên cứu khác, chúng ta cần điều tra xem đâu là căn bệnh mà công nghệ tế bào iPS sẽ có khả năng điều trị hiệu quả.
Có thông tin cho rằng các tế bào iPS có thể gây ra sự đào thải miễn dịch. Điều đó có đúng không?
Vào tháng 5 năm 2011, các tế bào iPS chuẩn bị từ chuột đã được cấy vào những con chuột khác giống hệt nhau về mặt di truyền. Các phát hiện đã báo cáo rằng các tế bào iPS có thể có nhiều khả năng gây ra phản ứng miễn dịch hơn so với các tế bào gốc phôi (ES), và phát hiện này đã được đưa tin rộng rãi trên các phương tiện truyền thông (Zhao et al. Nature. 2011 May 13;474(7350): 212-215). Ra đời vào thời điểm mà cho đến nay vẫn chưa có phân tích rõ ràng về phản ứng nào có thể xảy ra sau khi cấy ghép tế bào iPS, đây là một báo cáo quan trọng. Tuy nhiên, CiRA tin rằng cần phải thử nghiệm chi tiết hơn và đã phản hồi bằng một bài bình luận đăng trên tạp chí Hoa Kỳ (Okita et al. Circulation Research 2011 Sep16;109(7):720-721.).
Trong nghiên cứu do Zhao và các đồng nghiệp thực hiện, các tế bào iPS không biệt hóa đã được sử dụng trong quá trình cấy ghép, nhưng điều này trên thực tế hoàn toàn khác với những gì sẽ xảy ra trong ứng dụng y tế thực tế. Việc cấy ghép tế bào iPS không biệt hóa dẫn đến sự hình thành u quái, vì vậy khi tế bào được sử dụng trong thực hành y tế, trước tiên chúng được tạo ra để biệt hóa hoàn toàn thành loại tế bào đích và chỉ có thể được cấy ghép sau khi loại bỏ bất kỳ tế bào không biệt hóa nào. Khi các khối u hình thành trong cơ thể chúng ta, hệ thống miễn dịch sẽ phản ứng nhằm tiêu diệt chúng. Ngay cả khi u quái hình thành bằng cách cấy các tế bào iPS tự thân ở trạng thái không biệt hóa, như trong nghiên cứu của Zhao và cộng sự,
Vào năm 2013, Giáo sư Jun Takahashi của CiRA và nhóm của ông đã thực hiện nghiên cứu trong đó các tế bào thần kinh được tạo ra từ tế bào iPS được cấy vào não khỉ. Họ báo cáo rằng tế bào thần kinh có nguồn gốc từ tế bào iPS được tạo ra từ chính tế bào của động vật hầu như không gây ra phản ứng miễn dịch nào . Bây giờ chúng ta cần nghiên cứu xem liệu phản ứng miễn dịch có xảy ra trong những điều kiện này hay không, điều này phản ánh phản ứng của thực hành cấy ghép y tế thực tế.
Vào năm 2017, một nghiên cứu sử dụng khỉ đã báo cáo rằng phản ứng miễn dịch có thể bị ức chế ở một mức độ nào đó, ngay cả khi các tế bào đến từ những con khỉ khác, bằng cách kết hợp MHC (HLA trong trường hợp của con người), một kháng nguyên chứa nhiều gen liên quan đến phản ứng miễn dịch.
Năm 2019, nhóm nghiên cứu của CiRA do Giáo sư Shin Kaneko và Phó Giáo sư Akitsu Hotta đứng đầu đã thông báo rằng họ đã sử dụng công nghệ chỉnh sửa bộ gen để tạo ra các tế bào iPS có nguy cơ bị đào thải thấp. Do đó, nghiên cứu đang được tiến hành để ngăn chặn các phản ứng miễn dịch khi cấy ghép bằng tế bào iPS.
Những vấn đề nào liên quan đến sự an toàn của tế bào iPS?
Nghiên cứu đang được tiến hành ở Nhật Bản và nước ngoài với mục đích hiện thực hóa liệu pháp cấy ghép tế bào sử dụng tế bào iPS. Một vấn đề an toàn cần quan tâm là nguy cơ hình thành khối u. CiRA nói riêng đã tập trung nguồn lực của mình vào vấn đề này.
Nói rộng ra, có hai giả thuyết chính về cơ chế nhờ đó các tế bào iPS có thể hình thành khối u. Một giả thuyết cho rằng các tế bào iPS hình thành khối u để đáp ứng với việc kích hoạt lại các yếu tố tái lập trình được đưa vào tế bào hoặc do tổn thương gây ra cho bộ gen của tế bào ban đầu thông qua việc chèn nhân tạo các yếu tố tái lập trình. Để đáp lại, một cuộc tìm kiếm đã được đưa ra để tìm các yếu tố tái lập trình tối ưu không gây ra sự kích hoạt lại và một phương pháp tạo ra các tế bào iPS đã được phát triển trong đó các yếu tố tái lập trình không được tích hợp vào nhiễm sắc thể của tế bào và do đó tránh được sự phá hủy bộ gen của vật chủ.
Giả thuyết khác cho rằng phần còn lại của các tế bào không phân biệt – các tế bào không hoàn thành quá trình biệt hóa thành loại tế bào đích – hoặc các yếu tố khác dẫn đến sự hình thành u quái, một loại khối u lành tính. Lý thuyết này yêu cầu nghiên cứu về sự tăng sinh và biệt hóa của tế bào iPS.
1. Tìm kiếm các yếu tố tái lập trình tối ưu
Khi Giáo sư Shinya Yamanaka và nhóm nghiên cứu của ông công bố tạo thành công tế bào iPS của chuột, một trong những yếu tố tái lập trình mà họ sử dụng là c-Myc, được biết đến là một gen gây ung thư, tức là gen gây ung thư. Đã có những ý kiến cho rằng gen này có thể được kích hoạt trong tế bào và khiến khối u hình thành. Tuy nhiên, vào năm 2010, Giảng viên Masato Nakagawa của CiRA và nhóm của ông đã báo cáo rằng L-Myc là nhân tố thay thế đầy hứa hẹn cho c-Myc . Các tế bào iPS được tạo bằng L-Myc không chỉ hầu như không hình thành khối u mà còn có tỷ lệ tạo thành công cao và mức độ đa năng cao.
2. Tìm kiếm vectơ tối ưu
Khi các yếu tố tái lập trình cần thiết để tạo ra các tế bào iPS được đưa vào các tế bào của da hoặc các mô khác của cơ thể, các phương pháp ban đầu sử dụng retrovirus hoặc lentillin làm “vectơ” hoặc chất mang. Trong các phương pháp này, các gen mục tiêu được đưa vào vi-rút mà các tế bào sau đó đã bị lây nhiễm để cung cấp các gen mục tiêu. Tuy nhiên, khi một retrovirus hoặc lent siêu vi được sử dụng làm véc tơ, thì các virus này được tích hợp vào DNA bộ gen của tế bào theo kiểu ngẫu nhiên. Điều này có thể khiến một số gen ban đầu của tế bào bị mất đi, hoặc trong một số trường hợp khác được kích hoạt, dẫn đến nguy cơ biến đổi thành ung thư.
Vào năm 2008, để khắc phục rủi ro này, Giảng viên Keisuke Okita của CiRA và nhóm của ông đã khám phá việc sử dụng một đoạn DNA vòng được gọi là plasmid, không được tích hợp vào nhiễm sắc thể của tế bào, để thay thế cho các phương pháp retrovirus hoặc lentillin. Bằng cách này, họ đã phát triển một phương pháp tạo ra các tế bào iPS trong đó các yếu tố tái lập trình không được tích hợp vào nhiễm sắc thể của tế bào . Vào năm 2011, Okita và nhóm của ông đã cải thiện hơn nữa việc tạo ra hiệu quả bằng cách đưa vào một plasmid episomal tự sao chép sáu yếu tố – OCT3/4, SOX2, KLF4, LIN28, L-MYC và p53shRNA .
3. Xây dựng phương pháp tạo và sàng lọc tế bào an toàn
Sau khi các tế bào iPS đã được tạo ra để biệt hóa thành các tế bào soma đích bằng cách sử dụng các gen và phương pháp chèn gen thích hợp như đã giải thích ở trên, các tế bào đã biệt hóa có thể được dựa vào để không trở lại trạng thái không biệt hóa. Tuy nhiên, đôi khi có thể có tàn dư của các tế bào chưa biệt hóa chưa hoàn thành quá trình biệt hóa thành các tế bào đích và có thể những tế bào này, dù ít, có thể tạo thành khối u. Các nhà khoa học đã xác định rằng các dòng tế bào iPS khác nhau, ngay cả khi được tạo ra từ cùng một cá thể bằng cách sử dụng cùng một phương pháp, vẫn có thể cho thấy sự khác biệt về tiềm năng tăng sinh và biệt hóa. Điều này có nghĩa là, nếu các tế bào iPS có khả năng biệt hóa thấp được sử dụng, có nguy cơ là phần còn lại của các tế bào trong nhóm tế bào có thể không biệt hóa hoàn toàn và dẫn đến hình thành u quái. Vào năm 2013, một nhóm do Giảng viên CiRA Kazutoshi Takahashi và Tiến sĩ Michiyo Aoi, hiện là trợ lý giáo sư tại Đại học Kobe, dẫn đầu.đã phát triển một phương pháp đơn giản để sàng lọc các dòng tế bào iPS có khả năng biệt hóa cao thành các tế bào thần kinh . Ngoài ra còn có nguy cơ hình thành khối u từ bộ gen hoặc tổn thương khác phát sinh ở giai đoạn tạo tế bào iPS hoặc ở giai đoạn nuôi cấy tiếp theo. Trợ lý Giáo sư Akira Watanabe của CiRA và nhóm của ông đã phát triển một phương pháp nhạy cảm để phát hiện tổn thương bộ gen và các tổn thương khác trong tế bào iPS bằng cách sử dụng thiết bị mới nhất.
4. Phát triển phương pháp biệt hóa đáng tin cậy thành loại tế bào đích
Trong liệu pháp cấy ghép tế bào, các tế bào iPS không được cấy ghép trực tiếp vào cơ thể con người. Thay vào đó, các tế bào được cấy sau khi lần đầu tiên được biệt hóa thành loại tế bào đích. Do đó, điều quan trọng là phải phát triển một phương pháp đáng tin cậy để tạo ra các tế bào iPS để biệt hóa thành loại tế bào đích. CiRA hiện đang làm việc để phát triển công nghệ biệt hóa thành nhiều loại tế bào khác nhau từ tế bào iPS. Giáo sư Jun Takahashi của CiRA và nhóm của ông đã phát triển một phương pháp hiệu quả cao để tạo ra các tế bào iPS biệt hóa thành các tế bào thần kinh sản xuất dopamine. Vào năm 2014, Giáo sư Koji Eto của CiRA và nhóm của ông đã báo cáo mộtphương pháp sản xuất tiểu cầu từ các tế bào iPS vừa đáng tin cậy vừa có thể mang lại số lượng lớn . Những phát hiện này đại diện cho một bước quan trọng đối với thuốc tái tạo dựa trên tế bào iPS cho các bệnh thần kinh như bệnh Parkinson và các bệnh về máu như thiếu máu bất sản.
Đến bao giờ vấn đề an toàn mới được khắc phục?
Kể từ khi thế hệ tế bào iPS lần đầu tiên được báo cáo vào năm 2006, nghiên cứu đã dẫn đến tiến bộ lớn trong các phương pháp tạo, đồng thời các phương pháp đánh giá chất lượng cũng đang được áp dụng. Vào năm 2014, các tế bào biểu mô sắc tố võng mạc có nguồn gốc từ tế bào iPS đã được cấy ghép vào một bệnh nhân bị thoái hóa điểm vàng do tuổi tác (AMD), một cột mốc quan trọng trong việc sử dụng công nghệ tế bào iPS cho ứng dụng lâm sàng. Ngoài ra, trong trường hợp chấn thương tủy sống, bệnh Parkinson, suy tim và các bệnh về máu bao gồm thiếu máu bất sản, tính an toàn của thuốc tái tạo dựa trên tế bào iPS đã được kiểm tra trong các thí nghiệm trên động vật với hy vọng rằng nó sẽ được sử dụng cho bệnh nhân trong những năm tới.
Các tế bào iPS được tạo ra từ các tế bào của bệnh nhân có thể được sử dụng để tạo ra các tế bào tái tạo mô bị ảnh hưởng bởi bệnh tật. Kỹ thuật này mở ra triển vọng sử dụng các tế bào iPS để kiểm tra hiệu quả, tác dụng phụ và độc tính của thuốc cũng như để phát triển các loại thuốc và liệu pháp mới. Những vấn đề nào cần được giải quyết để thực hiện mục tiêu này?
So với khi tế bào động vật hoặc các vật liệu khác được sử dụng, nghiên cứu sử dụng tế bào được tạo ra từ tế bào iPS có nguồn gốc từ bệnh nhân có khả năng tạo ra các mô hình phản ánh chính xác hơn cơ chế gây bệnh ở người. Nói cách khác, nó sẽ cho phép chúng ta trả lời tốt hơn câu hỏi tại sao bệnh lại phát triển và kết quả là nó sẽ hữu ích hơn trong việc tìm kiếm các loại thuốc có thể ngăn chặn hoặc trì hoãn sự tiến triển của bệnh hoặc chữa khỏi bệnh. Ngoài ra, bằng cách tạo ra các tế bào iPS từ nhiều nền tảng di truyền khác nhau, khiến chúng biệt hóa thành các tế bào của tim, gan hoặc các cơ quan khác dễ bị tác dụng phụ của thuốc, sau đó cho các tế bào này tiếp xúc với các hợp chất hóa học làm cơ sở cho thuốc. ,
Loại nghiên cứu này sẽ không chỉ thúc đẩy cấy ghép tế bào mà còn cung cấp các liệu pháp điều trị cho nhiều bệnh nhân hơn. Do đó, chúng tôi mong muốn được thấy nghiên cứu như vậy được thúc đẩy mạnh mẽ trong tương lai. Tuy nhiên, liệu những bất thường quan sát được ở cấp độ tế bào khi sử dụng công nghệ tế bào iPS có phải là nguyên nhân thực sự gây ra căn bệnh thực sự của bệnh nhân hay không thì cần phải được nghiên cứu kỹ lưỡng. Nghiên cứu trên diện rộng cũng cần thiết để kiểm tra hiệu quả của các loại thuốc được phát hiện bằng kỹ thuật tế bào iPS và liệu những loại thuốc này có đủ an toàn hay không.
Tuy nhiên, cần phải phân tích cẩn thận xem liệu những bất thường được quan sát ở cấp độ tế bào có phải là nguyên nhân thực sự gây ra bệnh của bệnh nhân hay không, đồng thời tái tạo tình trạng của bệnh nhân. Chúng tôi cũng cần xác nhận rộng rãi mức độ hiệu quả của các loại thuốc được phát hiện bằng cách sử dụng tế bào iPS đối với bệnh nhân và liệu chúng có đủ an toàn hay không. Các thử nghiệm lâm sàng đã được bắt đầu cho bệnh nhân FOP (loạn sản xơ hóa cốt hóa tiến triển) vào năm 2017, bệnh nhân xơ cứng teo cơ một bên (ALS) vào năm 2019 và bệnh nhân mắc bệnh Alzheimer gia đình vào năm 2020.
Yhocvn.net (theo UCLA)
Chưa có bình luận.