FDA chấp thuận liệu pháp tế bào B nhắm mục tiêu Kesimpta (ofatumumab) cho bệnh nhân đa xơ cứng tái phát. Basel, ngày 20 tháng 8 năm 2020 – hãng Novartis hôm nay thông báo rằng Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) đã phê duyệt Kesimpta® (ofatumumab, trước đây là OMB157) dưới dạng thuốc tiêm để sử dụng dưới da để điều trị các dạng tái phát của bệnh đa xơ cứng (RMS), gồm hội chứng về mặt lâm sàng, bệnh tái phát và bệnh tiến triển thứ phát đang hoạt động, ở người lớn.
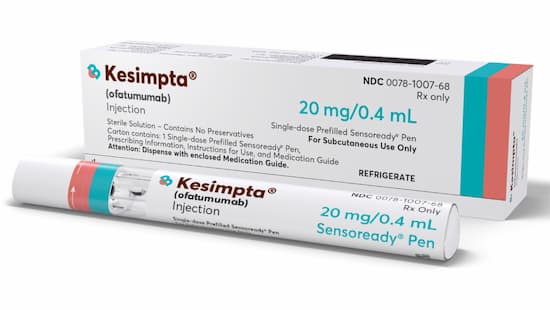
Kesimpta là một liệu pháp tế bào B được phân phối và phân phối đúng liều lượng, nhắm mục tiêu đã cho thấy hiệu quả vượt trội với tính an toàn tương tự so với teriflunomide và là lựa chọn điều trị đầu tiên cho bệnh nhân RMS 1 . Kesimpta là liệu pháp tế bào B đầu tiên có thể tự sử dụng mỗi tháng một lần tại nhà thông qua bút tiêm tự động Sensoready®.
“Sự chấp thuận này là một tin tuyệt vời cho những bệnh nhân mắc bệnh đa xơ cứng tái phát. Trong các nghiên cứu lâm sàng quan trọng, phương pháp điều trị đột phá này giúp giảm đáng kể các tổn thương não mới, giảm tái phát và làm chậm sự tiến triển của bệnh cơ bản”Giáo sư Stephen L. Hauser, Giám đốc Viện Khoa học Thần kinh UCSF Weill và đồng chủ trì chỉ đạo. ủy ban cho các nghiên cứu ASCLEPIOS I và II. “Thông qua tính an toàn thuận lợi và chế độ tiêm hàng tháng được dung nạp tốt, bệnh nhân có thể tự điều trị tại nhà, tránh phải đến trung tâm truyền dịch”.
Một trong những mục tiêu khi quản lý RMS là bảo tồn chức năng thần kinh để làm chậm sự xấu đi của tình trạng khuyết tật4. Bất chấp sự sẵn có của một số liệu pháp điều chỉnh bệnh (DMT) để điều trị RMS, phần lớn những người mắc RMS vẫn tiếp tục trải qua hoạt động của bệnh 5 . Bằng chứng cho thấy việc bắt đầu sớm điều trị hiệu quả cao có thể cải thiện kết quả lâu dài cho bệnh nhân đa xơ cứng.
Bruce Bebo, Tiến sĩ, Phó Chủ tịch Điều hành Nghiên cứu tại National MS Society cho biết: “Đa xơ cứng (MS) là một căn bệnh phức tạp và phản ứng với điều trị thay đổi bệnh sẽ khác nhau giữa các cá nhân. “Điều này làm cho điều quan trọng là phải có sẵn một loạt các phương pháp điều trị với các cơ chế hoạt động và đường dùng khác nhau. Chúng tôi rất vui khi có thêm một lựa chọn được chấp thuận để điều trị các dạng đa xơ cứng tái phát ”
Theo truyền thống, các phương pháp điều trị tế bào B, liên kết và làm cạn kiệt tế bào B liên quan đến hoạt động của bệnh trong MS, chủ yếu có sẵn tại các bệnh viện hoặc trung tâm điều trị truyền dịch, có thể làm tăng thêm chi phí cho hệ thống chăm sóc sức khỏe và tạo ra gánh nặng lối sống cho một số bệnh nhân 7 , 8 . Kesimpta cung cấp cho bệnh nhân sự linh hoạt trong việc tự sử dụng thuốc qua liều tiêm dưới da mỗi tháng một lần mà không cần phải điều trị trước, loại bỏ sự cần thiết phải đến trung tâm truyền dịch. Các kết quả khả quan từ nghiên cứu APLIOS – một nghiên cứu giai đoạn II nhãn mở để xác định tương đương sinh học của việc cung cấp Kesimpta dưới da thông qua một ống tiêm được bơm đầy sẵn và bút Sensoready ở bệnh nhân RMS – và các nghiên cứu ASCLEPIOS cho thấy Kesimpta là một B- liệu pháp tế bào có thể dễ dàng tự quản lý tại nhà.
Marie-France Tschudin, Chủ tịch Novartis Pharmaceuticals cho biết: “Tại Novartis, chúng tôi tạo các mô hình điều trị và cố gắng đưa ra lựa chọn điều trị tốt nhất cho bệnh nhân. “Khi điều trị cho bệnh nhân đa xơ cứng, Kesimpta là một lựa chọn điều trị có ý nghĩa, vừa mang lại hiệu quả cao vừa an toàn với khả năng cho bệnh nhân tự do hơn trong việc kiểm soát bệnh của mình. Sự phát triển của Kesimpta là một ví dụ tuyệt vời về cam kết, kiến thức và hiểu biết của chúng tôi về bệnh đa xơ cứng, cho phép chúng tôi xác định một phương pháp điều trị mục tiêu có thể cải thiện đáng kể kết quả và trải nghiệm của bệnh nhân”
Ofatumumab lần đầu tiên được FDA chấp thuận vào năm 2009 để điều trị bệnh bạch cầu lymphocytic mãn tính (CLL) dưới dạng truyền tĩnh mạch với liều cao, do nhà cung cấp dịch vụ chăm sóc sức khỏe thực hiện. Ofatumumab sau đó đã được nghiên cứu trong một chương trình phát triển hoàn toàn mới trong RMS, vì tế bào B được biết là đóng một vai trò quan trọng trong sự phát triển của các bệnh tự miễn dịch, chẳng hạn như MS7. Chương trình phát triển lâm sàng cho ofatumumab trong RMS đã mất 10 năm và đã thu hút hơn 2.300 bệnh nhân trên khắp thế giới tham gia như một phần của các nghiên cứu nghiêm ngặt phản ánh số lượng bệnh nhân rộng rãi. Kesimpta được phát hiện hoạt động thông qua một phương thức hành động riêng biệt và phác đồ điều trị (liều lượng) – được thiết kế đặc biệt cho RMS — đóng một vai trò quan trọng trong kết quả.
Việc phê duyệt Kesimpta dựa trên kết quả từ các nghiên cứu ASCLEPIOS I và II Giai đoạn III, trong đó Kesimpta thể hiện tính ưu việt hơn teriflunomide trong việc giảm đáng kể tỷ lệ tái phát hàng năm (ARR, điểm cuối chính), tiến triển tàn tật được xác nhận trong 3 tháng (CDP), và số lượng T1 tăng cường gadolinium (Gd +) và các tổn thương T2 mới hoặc mở rộng 1 . Kết quả từ hai nghiên cứu này gần đây đã được công bố trên tạp chí The New England Journal of Medicine ngày 6 tháng 8 năm 2020.
Kesimpta dự kiến sẽ có mặt tại Hoa Kỳ vào đầu tháng 9. * Các hồ sơ pháp lý bổ sung hiện đang được tiến hành trên toàn thế giới và phê duyệt theo quy định cho Kesimpta ở Châu Âu dự kiến vào quý 2 năm 2021.
Kesimpta có tính an toàn tương tự như teriflunomide, với tần suất nhiễm trùng nghiêm trọng và khối u ác tính cũng tương tự nhau ở cả hai nhóm điều trị 1. Nhiễm trùng đường hô hấp trên, nhức đầu, phản ứng liên quan đến tiêm và phản ứng tại chỗ tiêm là những phản ứng có hại thường được quan sát thấy nhất với Kesimpta (tỷ lệ mắc bệnh lớn hơn 10%).
Một phân tích post hoc riêng biệt đã chứng minh Kesimpta có thể ngăn chặn hoạt động của bệnh mới ở bệnh nhân RMS. Nó cho thấy tỷ lệ không đạt được bằng chứng về hoạt động của bệnh (NEDA-3; không tái phát, không có tổn thương MRI, và không kết hợp với tình trạng tàn tật nặng hơn) với ofatumumab so với teriflunomide cao hơn gấp 3 lần ở Tháng 0-12 (47,0% so với 24,5% của bệnh nhân; P <0,001) và cao hơn gấp 8 lần ở Tháng 12–24 (87,8% so với 48,2% bệnh nhân; P <0,001).
Nhìn chung Kesimpta, một kháng thể nhắm mục tiêu vào các tế bào B dương tính với CD20, mang lại hiệu quả vượt trội và chứng minh tính an toàn với tỷ lệ lây nhiễm tương tự như teriflunomide.
Về nghiên cứu APLIOS
Nghiên cứu APLIOS là một nghiên cứu tương đương sinh học giai đoạn II, nhãn mở, kéo dài 12 tuần để xác định sự khởi đầu của sự suy giảm tế bào B khi tiêm dưới da Kesimpta hàng tháng và tương đương sinh học của việc tiêm dưới da Kesimpta qua ống tiêm đã được nạp sẵn – như được sử dụng trong ASCLEPIOS I và II — và bút Sensoready ở bệnh nhân RMS. Bệnh nhân được chọn ngẫu nhiên theo thiết bị và vị trí tiêm bao gồm bụng và đùi. Sự suy giảm tế bào B được đo chín lần trong 12 tuần và số lượng tổn thương Gd + được đánh giá lúc ban đầu và ở các Tuần 4, 8 và 12. Bất kể thiết bị hoặc vị trí tiêm, tiêm dưới da Kesimpta 20 mg hàng tháng cho kết quả nhanh chóng, gần hoàn thành và duy trì Suy giảm tế bào B; tỷ lệ bệnh nhân có nồng độ tế bào B <10 tế bào / μL là> 65% sau lần tiêm đầu tiên vào Ngày thứ 7, 94% vào Tuần thứ 4, và duy trì> 95% ở tất cả các lần tiêm sau. Điều trị Kesimpta làm giảm số lượng tổn thương Gd + trung bình so với ban đầu (1,5) xuống 0,8, 0,3 và 0,1 lần lượt vào Tuần 4, 8 và 12; tỷ lệ bệnh nhân không bị tổn thương Gd + tại các thời điểm tương ứng là 66,5%, 86,7% và 94,1%.
Giới thiệu về Kesimpta (ofatumumab, trước đây là OMB157)
Kesimpta là liệu pháp điều trị tế bào B có mục tiêu, liều lượng và phân phối chính xác, cung cấp khả năng tự quản lý linh hoạt cho người lớn mắc RMS. Nó là một kháng thể đơn dòng chống CD20 (mAb) tự sử dụng bằng cách tiêm mỗi tháng một lần, được tiêm dưới da 1,3 . Liều nạp ban đầu của Kesimpta được tiêm vào Tuần 0, 1 và 2, với mũi tiêm đầu tiên được thực hiện dưới sự hướng dẫn của chuyên gia chăm sóc sức khỏe. Như đã chỉ ra trong các nghiên cứu tiền lâm sàng, Kesimpta được cho là hoạt động bằng cách liên kết với một biểu mô khác biệt trên phân tử CD20 gây ra sự ly giải và suy giảm tế bào B mạnh mẽ 9. Cơ chế hoạt động chọn lọc và tiêm dưới da của Kesimpta cho phép phân phối chính xác đến các hạch bạch huyết, nơi cần sự suy giảm tế bào B trong MS và các nghiên cứu tiền lâm sàng đã chỉ ra rằng nó có thể bảo tồn tế bào B trong lá lách 11 . Liều Kesimpta mỗi tháng một lần cũng cho phép bổ sung tế bào B nhanh hơn và mang lại sự linh hoạt hơn 12 . Ofatumumab ban đầu được phát triển bởi Genmab và được cấp phép cho GlaxoSmithKline. Novartis đã giành được quyền đối với ofatumumab từ GlaxoSmithKline trong tất cả các chỉ định, bao gồm cả RMS, vào tháng 12 năm 2015.
Về bệnh đa xơ cứng
Bệnh đa xơ cứng (MS) là một bệnh viêm mãn tính của hệ thần kinh trung ương, đặc trưng bởi sự phá hủy myelin và tổn thương các trục trong não, dây thần kinh thị giác và tủy sống14. MS, ảnh hưởng đến khoảng 2,3 triệu người trên toàn thế giới 15 , có thể được đặc trưng thành bốn loại MS chính: hội chứng phân lập lâm sàng (CIS), thuyên giảm tái phát (RRMS), tiến triển thứ phát (SPMS) và tiến triển nguyên phát (PPMS) 16 . Các dạng MS khác nhau có thể được phân biệt dựa trên việc bệnh nhân có bị tái phát hay không (các đợt viêm cấp tính được xác định rõ ràng làm suy giảm chức năng thần kinh) và / hoặc liệu họ có trải qua sự tiến triển của tổn thương thần kinh và tàn tật từ khi bệnh khởi phát hay không.
Yhocvn.net (theo drug)
Chưa có bình luận.